Kim loại kiềm thổ là gì
Kiềm thổ là sắt kẽm kim loại có đặc điểm hoá học với vật lý tương tự cùng với kim loại kiềm vị vậy cơ mà khôn xiết đa số chúng ta học viên dễ bị lầm lẫn thân 2 nhóm sắt kẽm kim loại này.
Bạn đang xem: Kim loại kiềm thổ là gì
Trong bài viết này chúng ta cùng tìm hiểu kim loại kiềm thổ là gì? kiềm thổ có đặc thù hoá học tập và trang bị lý làm sao đặc trưng và nó khác gì đối với kim loại kiềm bọn họ sẽ tò mò sinh hoạt bài bác trước.
I. Vị trí cấu tạo của sắt kẽm kim loại kiềm thổ
- Kyên ổn loại kiềm thổ thuộc nhóm IIA của bảng tuần hoàn; vào một chu kì, kiềm thổ lép vế kim loại kiềm.
- Klặng một số loại kiềm thổ gồm: Beri (Be); Magie (Mg); Canxi (Ca); Stronti ( Sr); Bari (Ba); Rađi (Ra) (Rađi là nguim tố pngóng xạ ko bền).
- Cấu hình electron lớp bên ngoài cùng là: ns2 (cùng với n là thiết bị trường đoản cú lớp)
II. Tính chất đồ dùng lý của sắt kẽm kim loại kiềm thổ
- Màu sắc : kim loại kiềm thổ có white color bạc hoặc xám nphân tử, hoàn toàn có thể rát mỏng dính.
- Nhiệt nhiệt độ rã với ánh sáng sôi Mặc dù bao gồm cao hơn nữa kim loại kiềm tuy nhiên vẫn kha khá thấp
- Kân hận lượng riêng kha khá nhỏ tuổi, nhẹ nhàng hơn nhôm trừ Bari
- Độ cứng cao hơn sắt kẽm kim loại kiềm nhưng lại vẫn tương đối mềm
III. Tính chất hoá học của sắt kẽm kim loại kiềm thổ
- Các kim loại kiềm thổ có tính khử mạnh dạn, yếu đuối hơn đối với sắt kẽm kim loại kiềm. Tính khử của những kim loại kiềm thổ tăng từ bỏ Be → Ba.
M – 2e → M2+
1. Kim một số loại kiềm thổ chức năng cùng với phi kim
- Khi đốt lạnh trong bầu không khí, các sắt kẽm kim loại kiềm thổ phần đông bốc cháy tạo nên oxit, bội nghịch ứng phạt ra các sức nóng.
2Mg + O2 → 2MgO
- Trong không gian độ ẩm Ca, Sr, Ba khiến cho lớp cacbonat (làm phản ứng cùng với bầu không khí như oxi) vì thế phải bảo quản những kim loại này trong bình siêu kín hoặc dầu hỏa khan.
- lúc làm cho nóng, tất cả các kim loại kiềm thổ liên quan mạnh mẽ với haloren, nitơ, sulfur, photpho, cacbon, siliC.
Ca + Cl2 → CaCl2
2Mg + Si → Mg2Si
- Do có ái lực lớn hơn oxi, khi đun nóng những sắt kẽm kim loại kiềm thổ khử được nhiều oxit bền (B2O3, CO2, SiO2, TiO2, Al2O3, Cr2O3,).
2Be + TiO2 → 2BeO + Ti
2Mg + CO2 → 2MgO + C
2. Kim loại kiềm thổ chức năng với axit
a) HCl, H2SO4 (loãng) : Kim các loại kiềm khử ion H+ thành H2
Mg + 2H+ → Mg2+ + H2↑
b) HNO3, H2SO4 đặc : Khử N+5, S+6 thành các đúng theo hóa học gồm nấc oxi hoá rẻ hơn.
4Ca + 10HNO3 (loãng) → 4Ca(NO3)2 + NH4NO3 + 3H2O
Mg + 4HNO3 đặc → Mg(NO3)2 + 2NO2↑ + 2H2O
4Mg + 5H2SO4 đặc → 4MgSO4 + H2S↑ + 4H2O
3. Kyên nhiều loại kiềm thổ tính năng với nước
- Ca, Sr, Ba chức năng cùng với nước sinh hoạt ánh sáng thường tạo thành hỗn hợp bazơ:
Ca + 2H2O → Ca(OH)2 + H2↑
- Mg không chảy nội địa rét mướt, tan chậm trong nước lạnh tạo ra thành MgO.
Mg + H2O → MgO + H2↑
- Be không chảy trong nước cho dù sống ánh sáng cao vày gồm lớp oxit bền bảo vệ. Nhưng Be hoàn toàn có thể tan trong dung dịch kiềm táo tợn hoặc kiềm lạnh tung tạo berilat:
Be + 2NaOH + 2H2O → Na2
Be + 2NaOH(lạnh chảy) → Na2BeO2 + H2↑
IV. Ứng dụng và pha chế kim loại kiềm thổ
1. Ứng dụng của sắt kẽm kim loại kiềm thổ
- Klặng một số loại Be: làm cho chất phú gia để sản xuất hợp kim có tính bọn hồi cao, bền, chắc hẳn, không trở nên làm mòn.
- Kyên nhiều loại Ca: sử dụng làm hóa học khử để tách bóc oxi, sulfur ra khỏi thép, có tác dụng thô một số vừa lòng chất hữu cơ.
- Klặng loại Mg có khá nhiều ứng dụng hơn cả: tạo kim loại tổng hợp tất cả tính cứng, dịu, bền để chế tạo sản phẩm bay, thương hiệu lửa, ôtô… Mg còn được dùng để làm tổng hợp nhiều hợp hóa học cơ học. Bột Mg trộn với chất oxi hóa dùng để làm chế tạo hóa học chiếu sáng đêm tối cần sử dụng vào pháo sáng, thứ hình họa.
2. Điều chế sắt kẽm kim loại kiềm thổ
- Trong thoải mái và tự nhiên, sắt kẽm kim loại kiềm thổ chỉ trường thọ dạng ion M2+ trong số hợp chất.
- Phương thơm pháp cơ bạn dạng là năng lượng điện phân muối rét tung của chúng.
CaCl2 Ca + Cl2↑
MgCl2 Mg + Cl2↑
- Một số phương thức khác:
+ Dùng than ly khử MgO; CaO từ đolomit bởi febositic (thích hợp chất Si cùng Fe) ở nhiệt độ cao và vào chân không.
MgO + C → Mg + CO
CaO + 2MgO + Si → 2Mg + CaO.SiO2
+ Dùng nhôm tuyệt magie khử muối hạt của Ca, Sr, Ba vào chân ko ở 11000C → 12000C.
2Al + 4CaO → CaO.Al2O3 + 3Ca
2Al + 4SrO → SrO. Al2O3 + 3Sr
2Al + 4BaO → BaO. Al2O3 + 3Ba
V. Một số thích hợp chất quan trọng Canxi - kim loại kiềm thổ
1. Canxi oxit: CaO (Vôi sống)
- Tác dụng cùng với nước, lan nhiệt : CaO + H2O → Ca(OH)2 ít tung.
- Với axit : CaO + 2HCl → CaCl2 + H2O
- Với oxit axit : CaO + CO2 → CaCO3 ( vôi chết )
2. Các hiđroxit M(OH)2 của các kim loại kiềm thổ
a) Tính chất của những hidroxit
- Các hiđroxit M(OH)2 khan các sống dạng màu trắng.
- Tính tan: Be(OH)2; Mg(OH)2 vô cùng không nhiều tung vào nướC.
Ca(OH)2 tương đối không nhiều chảy ( 0,12g/100g H2O).
Các hiđroxit sót lại rã những trong nướC.
- Độ bền nhiệt độ của hiđroxit tăng tự Be → Ba: Mg(OH)2 thoát nước sinh hoạt 150◦C; Ba(OH)2 thoát nước ngơi nghỉ 1000◦C chế tạo thành oxit.
- Tính bazơ: Be(OH)2 là bazơ hết sức yếu ớt, Mg(OH)2 là bazơ vừa phải, Ca(OH)2; Ba(OH)2; Sr(OH)2 là bazơ khỏe mạnh.
b) Canxi hidroxit : Ca(OH)2 (Vôi tôi)
- Ít tan nội địa : Ca(OH)2 → Ca2+ + 2OH-
- Với axkhông nhiều : Ca(OH)2 + 2HCl → CaCl2 + H2O
- Với oxit axit : Ca(OH)2 + CO2 → CaCO3↓ + H2O
Ca(OH)2 + CO2 → Ca(HCO3)2
- Với d2 muối : Ca(OH)2 + Na2CO3 → CaCO3 + 2NaOH
c) Ứng dụng của các hidroxit
- Hợp hóa học hidroxit sắt kẽm kim loại kiềm thổ Ca(OH)2 vận dụng rộng rãi hơn cả :trộn vữa xây nhà, khử chua đất tdragon, cung cấp cloruavôi dùng để làm tẩy trắng cùng tiệt trùng.
3. Canxi cacbonat (CaCO3) và Canxi hidro cacbonat Ca(HCO3)2
| CaCO3 : Canxi cacbonat | Ca(HCO3)2 : Canxi hidro cacbonat |
Với nước | Canxi cacbonat là chất rắn màu trắng, không chảy trong nước. cơ mà tung vào amoniclorua: CaCO3 + 2NH4Cl → CaCl2 + 2NH3↑ + CO2↑ + H2O | Tan vào nước: Ca(HCO3)2 → Ca2+ + 2HCO3- |
Với bazơ mạnh | Không làm phản ứng | Ca(HCO3)2 + Ca(OH)2 → 2CaCO3↓ + 2H2O |
Với axit mạnh | CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O | Ca(HCO3)2 + 2HCl → CaCl2 + 2CO2↑ + 2H2O lưỡng tính |
Nhiệt phân | Bị phân hủy sinh hoạt ánh sáng cao: CaCO3 -t0→ CaO + CO2↑ | Bị phân bỏ Lúc đun nóng nhẹ: Ca(HCO3)2 -t0→ CaCO3 + CO2↑ + H2O |
Phản ứng dàn xếp với CO2 , PO43- | Không |
Ca(OH)2 + CO2 → CaCO3↓ + H2O 3Ca(OH)2 + 2H3PO4 → Ca3(PO4)2↓ + 6H2O |
Với CO2 | CaCO3 + CO2 + H2O ↔ Ca(HCO3)2 ko tung tan Chiều thuận (1): Giải thích hợp sự xâm thực của nước mưa đối với đá vôi chế tạo ra hang cồn. Chiều nghịch (2): Giải say đắm sự sản xuất thành thạch nhũ vào hang cồn. |
4. Canxi sunfat (CaSO4)
a) Tính chất của can xi sunfat
- Là hóa học rắn white color chảy không nhiều trong nước (nghỉ ngơi 25◦C tan 0,15g/100g H2O).
- Tùy theo lượng nước kết tinc trong muối bột sunfat, ta gồm 3 loại:
+ CaSO4.2H2O : thạch cao sinh sống trong tự nhiên, bền sinh sống ánh nắng mặt trời thường xuyên.
+ CaSO4.H2O hoặc CaSO4.0,5H2O : thạch cao nung (hemihiđrat)
+ CaSO4.2H2O → CaSO4.0,5H2O + 1,5H2O (125◦C)
- Đun nóng 200◦C; thạch cao nung thành thạch cao khan (CaSO4).
CaSO4.0,5H2O
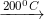
- CaSO4: không rã nội địa, ko tác dụng với nước, chỉ phân diệt ở ánh sáng rất cao.
2CaSO4
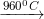
b) Ứng dụng của can xi sunfat
- Thạch cao nung rất có thể kết phù hợp với nước tao thành thạch cao sinh sống và Lúc đông cứng thì co và giãn thể tích, do vậy thạch cao siêu nạp năng lượng khuôn. Thạch cao nung thường được đúc tượng, đúc các chủng loại cụ thể tinc vi dùng trang trí thiết kế bên trong, có tác dụng phấn viết bảng, bó bột khi gãy xương,...
- Thạch cao sống dùng để cung ứng xi măng.
Xem thêm: Vạch Trần 7 Nguyên Nhân Gây Ngứa Bộ Phận Sinh Dục Nữ Là Bệnh Gì
5. Nước cứng
a) Khái niệm Nước cứng
- Nước cứng là nước tất cả chứa nhiều cation Ca2+, Mg2+. Nước đựng ít hoặc ko chứa những ion trên được Gọi là nước mềm.
b) Phân một số loại nước cứng
- Cnạp năng lượng cđọng vào nhân tố những anion cội axit tất cả nội địa cứng, bạn ta phân chia nước cứng ra 3 loại:
* Nước cứng tạm thời thời: Tính cứng trong thời điểm tạm thời của nước cứng là vì các muối Ca(HCO3)2, Mg(HCO3)2 tạo ra:
Ca(HCO3)2 → Ca2+ + 2HCO3-
- Goị là tạm thời vì chưng độ cứng vẫn thiếu tính khi đun sôi: M(HCO3)2 →MCO3 + CO2 + H2O
* Nước cứng vĩnh cửu: Tính cứng vĩnh cửu của nước là vì những muối bột CaCl2, MgCl2, CaSO4, MgSO4 tạo ra, Hotline là vĩnh cữu bởi vì Khi nấu nóng muối bột đó sẽ không phân hủy:
* Nước gồm tính cứng toàn phần: Là nước tất cả cả tính cứng trong thời điểm tạm thời và lâu dài.
- Nước tự nhiên thường sẽ có cả tính cứng tạm thời cùng tồn tại.
c) Ttai hại của nước cứng
* Về mặt đời sống thường ngày:
- Giặt áo xống bằng xà chống (natri stearat C17H35COONa) trong nước cứng sẽ khởi tạo ra muối hạt ko tan là can xi stearat (C17H35COO)2Ca, hóa học này chào bán trên vải vóc tua, làm cho áo xống mau mục nát.
2C17H35COONa +MCl2 →(C17H35COO)2M$ +2NaCl
- Nước cứng khiến cho xà chống tất cả ít bọt bong bóng, sút kĩ năng tẩy rửA.
- Nếu dùng nước cứng để làm bếp thức nạp năng lượng, đang làm cho thực phđộ ẩm lâu chín và sút vị vì bội phản ứng của các ion cùng những hóa học vào thực phẩm.
* Về khía cạnh cấp dưỡng công nghiệp:
- lúc đun nóng,sinh hoạt lòng nồi xuất xắc ống dẫn nước lạnh đã gây nên lớp cặn đá kém dẫn sức nóng có tác dụng hao phí hóa học đốt, tạo nổ nồi hơi với tắc nghẽn ống dẫn nước nóng (ko an toàn).
- Làm hư những hỗn hợp yêu cầu pha trộn.
- Vì vậy, vấn đề có tác dụng mềm nước cứng trước khi dùng có y nghĩa siêu đặc biệt quan trọng.
d) Các cách thức làm mềm nước cứng
- Nguyên tắc có tác dụng mềm nước cứng là giảm độ đậm đặc các cation Ca2+,Mg2+ nội địa cứng.
* Phương pháp kết tủa:
Đối cùng với nước tất cả tính cứng tạm thời- Đun sôi nước gồm tính cứng tạm thời trước khi dùng, muối bột hiđrocacbonat gửi thành muối cacbonat ko tan:
Ca(HCO3)2 → CaCO3↓ + CO2↑ + H2O
Mg(HCO3)2 → MgCO3↓ + CO2↑ + H2O
⇒ Lọc bỏ kết tủa được nước mềm.
- Dùng một cân nặng trọn vẹn dung dịch Ca(OH)2, Na2CO3 nhằm dung hòa muối bột hiđrocacbonat thành muối bột cacbonat kết tủA. Lọc vứt hóa học ko tan, được nước mềm:
Ca(HCO3)2 + Ca(OH)2 → 2CaCO3 + 2H2O
Mg(HCO3)2 + 2Ca(OH)2 → Mg(OH)2 + 2CaCO3 + 2H2O
M(HCO3)2 + Na2CO3 → MCO3 + 2NaHCO3
Đối cùng với nước có tính cứng vĩnh cửu:- Dùng dung dịch Na2CO3, Ca(OH)2 với hỗn hợp Na3PO4 để làm mềm nước cứng:
Ca2+ + CO32- → CaCO3↓
3Ca2+ + 2PO43- → Ca3(PO4)2↓
Mg2+ + CO32- + Ca2+ + 2OH- → Mg(OH)2↓ + CaCO3↓
* Pmùi hương pháp hội đàm ion:
- Phương pháp Bàn bạc ion được sử dụng thông dụng để triển khai mượt nướC. Phương thơm pháp này dựa trên tài năng điều đình ion của các hạt zeolit (những alumino silicat kết tinc, có trong tự nhiên hoặc được tổng hòa hợp, vào tinc thể bao gồm đựng phần nhiều lỗ trống nhỏ) hoặc nhựa thảo luận ion.
- Thí dụ: Cho nước cứng trải qua chất điều đình ion là những hạt zeolit thì số mol ion Na+ của zeolit ra khỏi mạng tinc thể, lấn sân vào nội địa nhường địa điểm cho những ion Ca2+ với Mg2+ bị gìn giữ trong mạng tinc thể silicat.
VI. các bài tập luyện về Kyên ổn một số loại kiềm thổ
Bài 2 trang 119 SGK Hóa 12: Cho dung dịch Ca(OH)2 vào hỗn hợp Ca(HCO3)2 sẽ
A. Có kết tủa trắng.
B. Có bọt bong bóng khí thoát ra.
C. Có kết tủa trắng với bọt bong bóng khí.
D. Không có hiện tượng lạ gì.
* Lời giải bài xích 2 trang 119 SGK Hóa 12:
Đáp án: A.Có kết tủa White.- PTPƯ: Ca(OH)2 + Ca(HCO3)2
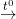
Bài 3 trang 119 SGK Hóa 12: Cho 2,84 g các thành phần hỗn hợp CaCO3 cùng MgCO3 tác dụng hết cùng với hỗn hợp HCl thấy bay ra 672 ml khí CO2 (đktc). Phần trăm khối lượng của nhị muối bột (CaCO3 , MgCO3) vào tất cả hổn hợp là :
A. 35,2 % và 64,8%.
B. 70,4% và 29,6%.
C. 85,49% với 14,51%.
D. 17,6% với 82,4%.
* Lời giải bài bác 3 trang 119 SGK Hóa 12:
Đáp án: B.70,4% và 29,6%.- hotline x, y theo thứ tự là số mol của CaCO3 và MgCO3 vào láo lếu hợp
ta có: 100x + 84y = 2,84 (1)
- Phương thơm trình hoá học của bội phản ứng:
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
x (mol) x
MgCO3 + 2HCl → MgCl2 + H2O + CO2↑
y (mol) y
- Theo bài xích ra, Số mol CO2: nCO2 = 0,672/22,4 = 0,03 (mol)
- Theo PTPƯ: nCO2 = x + y = 0,3 (2)
- Giải hệ PT (1) và (2) ta được, x = 0,02 (mol) và y = 0,01 (mol)
⇒ %mCaCO3 = <(0,02.100)/2,84>.100% = 70,42%
⇒ %mMgCO3 = 100% - 70,42% = 29,58%
Bài 4 trang 119 SGK Hóa 12: Cho 2g kim loại nhóm IIA tác dụng không còn với hỗn hợp HCl tạo nên 5,55g muối hạt clorua. Kyên các loại chính là sắt kẽm kim loại làm sao sau đây?
A. Be. B. Mg. C. Ca. D. Ba.
Lời giải bài bác 4 trang 119 SGK Hóa 12:
Đáp án: C. Ca- call M là sắt kẽm kim loại team II, số mol là x, ta có: Mx = 2 (1)
- Phương thơm trình hoá học của phản bội ứng:
M + 2HCl → MCl2 + H2↑
x (mol) x
- Theo PTPƯ ta có: (71+M)x = 5,55 (2)
- Giải hệ PT (1) cùng (2) ta được: x = 0,05 và M = 40
⇒ M là Ca
Bài 5 trang 119 SGK Hóa 12: Cho 2,8 g CaO tác dụng với một lượng nước lấy dư nhận được dung dịch A. Sục 1,68 lkhông nhiều CO2(đktc) vào hỗn hợp A.
a) Tính cân nặng kết tủa nhận được.
b) khi đun nóng dung dịch A thì trọng lượng kết tủa nhận được tối đa là bao nhiêu?
Lời giải bài xích 5 trang 119 SGK Hóa 12:
a) Theo bài xích ra, ta gồm số mol CaO là: nCaO = 2,8/56 = 0,05 (mol)
Số mol CO2 là nCO2 = 1,68/22,4 = 0,075 (mol)
- Phương thơm trình hoá học tập của bội phản ứng:
CaO + H2O → Ca(OH)2
0,05 (mol) 0,05 (mol)
CO2 + Ca(OH)2 → CaCO3↓ + H2O
0,05 0,05 0,05 (mol)
- Theo PTPƯ: nCaCO3 = nCO2 pư = nCa(OH)2 = 0,05 mol
⇒ nCO2 dư = 0,075 – 0,05 = 0,025 (mol)
- CaCO3 sinh sản thành 0,05 (mol) bị hòa hợp 0,025 (mol)
CO2 + CaCO3 + H2O → Ca(HCO3)2
0,025 0,025 0,025 (mol)
⇒ Số mol CaCO3 còn lại là: 0,05 – 0,025 = 0,025 (mol)
⇒ Kăn năn lượng CaCO3 là: mCaCO3 = 0,025. 100 = 2,5 (g)
b) Lúc làm cho nóng dung dịch A
Ca(HCO3)2
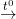
0,025 0,025 (mol)
⇒ Khối hận lượng kết tủa tối đa thu được là: mCaCO3 = (0,025 + 0,025).100 = 5 (g)
Bài 6 trang 119 SGK Hóa 12: lúc mang 14,25g muối clorua của một sắt kẽm kim loại chỉ có hóa trị II và một lượng muối bột nitrat của sắt kẽm kim loại đó bao gồm số mol bằng số mol muối hạt clorua thì thấy khác nhau 7,95g. Xác định thương hiệu kim loại
* Lời giải bài xích 6 trang 119 SGK Hóa 12:
- Call sắt kẽm kim loại bắt buộc tìm là M, gồm hóa trị là II
⇒ Công thức muối bột clorua là MCl2, bao gồm số mol là x
Ta bao gồm PT: (M + 71)x = 14,25 (1)
⇒ Công thức muối bột nitrat là M(NO3)2.
Ta tất cả PT: (M + 124)x = 14,25 + 7,95 (2)
- Giải hệ PT (1) với (2) ta được, x = 0,15, M = 24
⇒ M là Mg
Bài 7 trang 119 SGK Hóa 12: Hòa tan 8,2 gam tất cả hổn hợp bột CaCO3 với MgCO3 nội địa bắt buộc 2,016 lít CO2 (đktc). Xác định số gam từng muối bột vào tất cả hổn hợp.
* Lời giải bài bác 7 trang 119 SGK Hóa 12:
- gọi x, y theo lần lượt là số mol CaCO3 và MgCO3 trong lếu hợp
⇒ 100x + 84y = 8,2 (1)
- Theo bài ra, ta có: nCO2 = 2,016/22,4=0,09 (mol)
- Phương thơm trình hoá học của phản ứng:
CaCO3 + CO2 + H2O → Ca(HCO3)2
x x (mol)
MgCO3 + CO2 + H2O → Mg(HCO3)2
y y (mol)
- Theo PTPƯ: nCO2 = x + y = 0,09 (2)
- Giải hệ PT tất cả (1) và (2) ta được, x = 0,04 và y = 0,05
⇒ mCaCO3 = 0,04.100 = 4 (g)
⇒ mMgCO3 = 0,05.84 = 4,2 (g)
Bài 8 trang 119 SGK Hóa 12: Trong một ly nước gồm chứa 0,01 mol Na+ , 0,02 mol Ca2+, 0,01 mol Mg2+, 0,05 mol HCO3-, 0,02 mol Cl-. Nước vào ly ở trong các loại làm sao ?
A. Nước cứng có tính cứng trong thời điểm tạm thời.
B. Nước cứng bao gồm tính cứng mãi mãi.
C. Nước cứng bao gồm tính cứng toàn phần.
* Lời giải bài bác 8 trang 119 SGK Hóa 12:
Đáp án: C. Nước cứng tất cả tính cứng toàn phần.- Cốc nước trên đựng các ion: Ca2+, Mg2+, HCO3-, Cl-
⇒ Thuộc nước cứng toàn phần (bao gồm cả tính cứng trong thời điểm tạm thời với tính cứng vĩnh cửu)
Bài 9 trang 119 SGK Hóa 12: Viết pmùi hương trình hóa học của làm phản ứng nhằm giải thích việc cần sử dụng Na3PO4 để làm mềm nước cứng tất cả tính cứng toàn phần.
* Lời giải bài bác 9 trang 119 SGK Hóa 12:
- Các pmùi hương trình hoá học tập của làm phản ứng
3Ca(HCO3)2 + 2Na3PO4 → Ca3(PO4)2↓ + 6NaHCO3
3Mg(HCO3)2 + 2Na3PO4 → Mg3(PO4)2↓ + 6NaHCO3
3CaCl2 + 2Na3PO4 → Ca3(PO4)2↓ + 6NaCl
3CaSO4 +2Na3PO4 → Ca3(PO4)2↓ + 3Na2SO4.
- khi kia toàn bộ các ion Ca2+, Mg2+ phần đông kết tủa hết dưới dạng muối hạt photphat => làm cho mềm được nước cứng toàn phần.
Xem thêm: Chất Liệu Cát Giấy Là Gì ? Có Co Giãn Không? Phân Biệt Các Loại Vải Cát Hàn
Hy vọng cùng với bài viết khối hệ thống lại kiến thức và kỹ năng về đặc điểm hoá học của kim loại kiềm thổ, các hòa hợp hóa học đặc trưng của kim loại kiềm thổ với bài tập vận dụng ngơi nghỉ trên hữu ích cho các em. Mọi góp ý và thắc mắc các em hãy vướng lại phản hồi dưới bài viết và để được cung ứng, chúc những em tiếp thu kiến thức tốt.